化學藥在中國醫藥市場中仍占主導地位,占比高達48.9%。中國化學藥市場規模由2016年的7226億元增長至2019年的8190億元,2020年受疫情影響,市場規模略有下降,為7085億元。2021年,帶量采購進入常態化階段,在提高化學藥行業集中度、推動研發創新、促進上下游一體化等方面起到積極的推動作用,預計2021年中國化學藥市場規模將達到8466億元。
化學藥在中國醫藥市場中仍占主導地位,占比高達48.9%。中國化學藥市場規模由2016年的7226億元增長至2019年的8190億元,2020年受疫情影響,市場規模略有下降,為7085億元。2021年,帶量采購進入常態化階段,在提高化學藥行業集中度、推動研發創新、促進上下游一體化等方面起到積極的推動作用,預計2021年中國化學藥市場規模將達到8466億元。
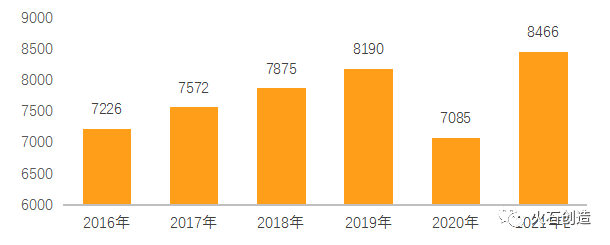
圖1:2015-2021E年中國化學藥市場規模(億元)來源:Frost&Sullivan、中商產業研究院,火石創造整理
1.仿制藥一致性評價迎來爆發
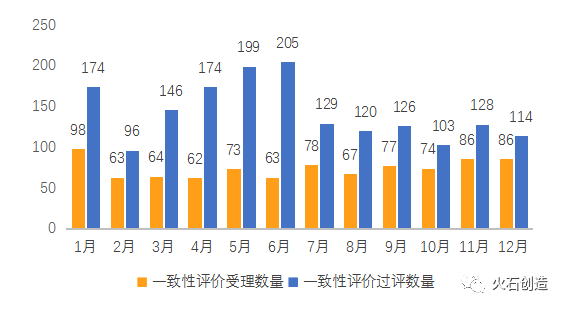
2021年累計有876個受理號申報一致性評價獲受理,同比2020年全年908個下降3.52%;有1714個品規的藥品通過一致性評價(含視同通過),約為2020年的兩倍,仿制藥一致性評價過評品種迎來爆發式增長。
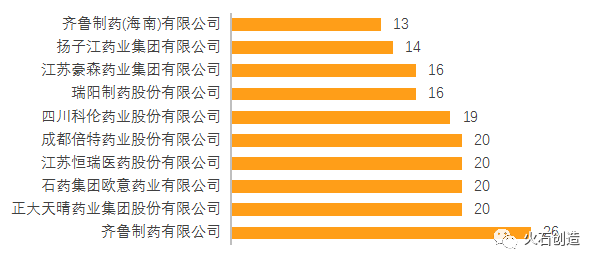
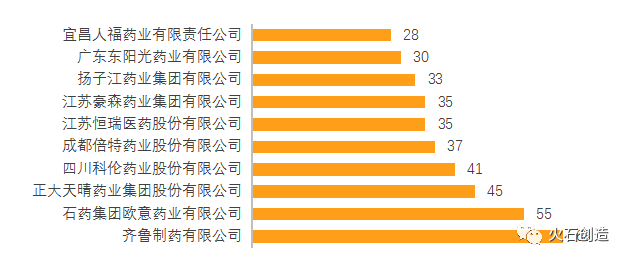
在企業方面,龍頭企業保持領先。2021年,齊魯制藥有26個品種通過一致性評價,拔得頭籌。正大天晴、石藥歐意、恒瑞醫藥、倍特藥業以20個品種位列第2位,四川科倫排名6位。在一致性評價通過品種總數上,齊魯制藥以63個品種占據第一,石藥歐意以55個品種位列第二。
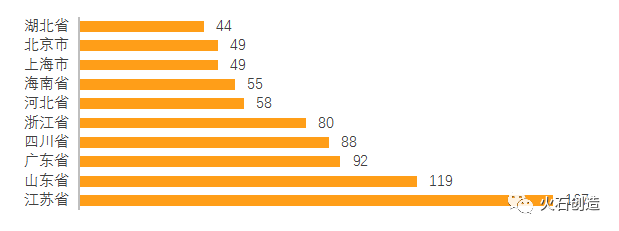
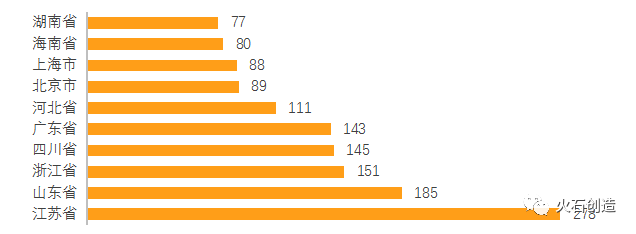
在區域上,傳統優勢區域排名靠前。2021年,江蘇省有167個品種通過一致性評價,超過去年全省總量,排名第一,同時也獲得過評品種總數第一。山東、廣東、四川、浙江分別位列過評數量的2-5位。
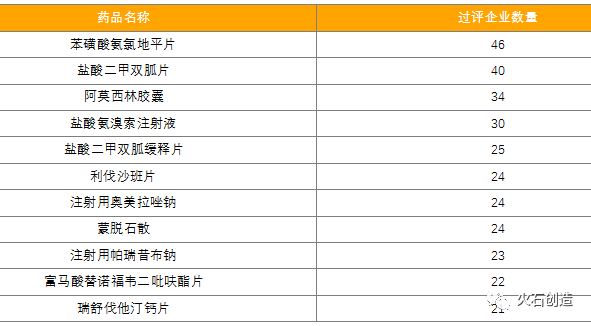
2021年,已經有206個同通用名產品過評企業超過3家,其中苯磺酸氨氯地平片過評企業達到46家,位列第一,鹽酸二甲雙胍片、阿莫西林膠囊、鹽酸氨溴索注射液過評企業也超過30家。在帶量采購常態化背景下,熱門產品的競爭日漸激烈。
2.改良型新藥進入收獲期
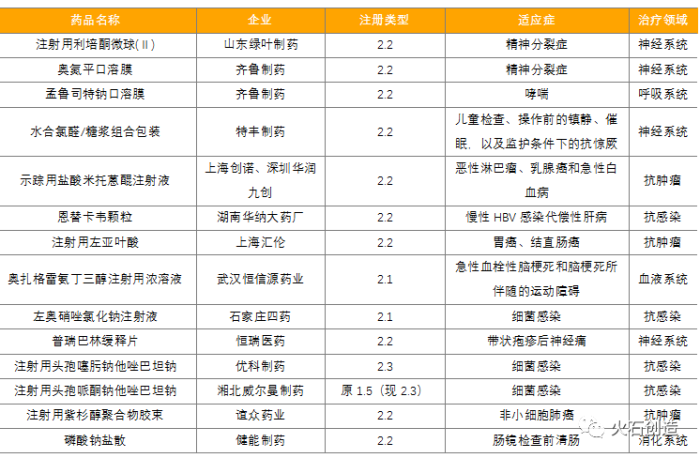
自2016年3月原CFDA發布《化學藥品注冊分類改革工作方案》,將新藥進一步分為1類新藥(創新藥)和2類新藥(改良型新藥)后,改良型新藥成為各藥企研發的熱門方向。2021年改良型新藥已進入收獲期,共有14個品種獲批上市(8個注射劑,6個口服制劑),其中2.2類改劑型品種多達10個,2.1類改晶型品種2個,2.3類新復方品種2個。綠葉制藥的利培酮微球為高端長效緩釋注射劑,湖南華納大藥廠的恩替卡韋顆粒劑為兒科品種,齊魯制藥獲批2款口溶膜,在該領域競爭優勢明顯。表2:2021年獲批上市國產2類改良型化學新藥列表
3.創新藥獲批數量再創新高
2021年共有21個國產1類化學新藥獲批上市,獲批數量超過2020年,再次創下藥品注冊分類新標準實施后的歷史新高。這21個化學新藥包括8個抗感染藥、6個抗腫瘤藥、2個血液系統藥物、2個消化系統藥物、1個神經系統藥物、1個心血管系統藥物、1個泌尿系統藥物,且共有16個產品以“優先審評”的方式獲批,其中注射用磷酸左奧硝唑酯二鈉、蘋果酸奈諾沙星氯化鈉注射液、帕米帕利膠囊、康替唑胺片、甲磺酸伏美替尼片、甲苯磺酸多納非尼片、海曲泊帕乙醇胺片、海博麥布片、艾諾韋林片、艾米替諾福韋片10個產品已通過國家醫保談判進入醫保目錄。此外,和黃醫藥的賽沃替尼片是國內首個獲批的特異性靶向MET激酶的小分子抑制劑,注射用的磷酸左奧硝唑酯二鈉則是揚子江藥業獲批上市的首個國產化學1類新藥。
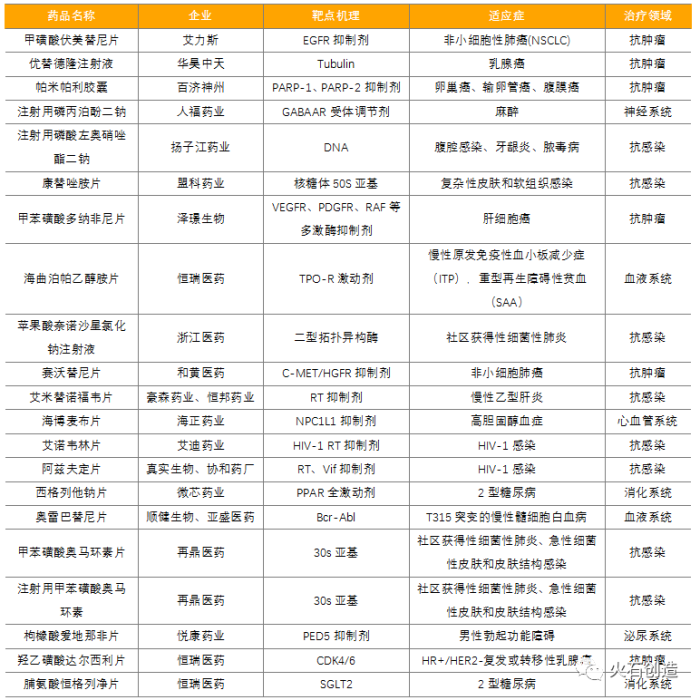
1.上市企業
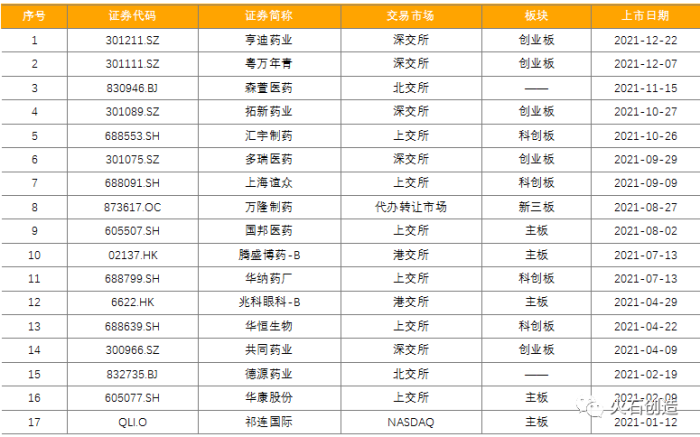
2021年,化學藥領域共有17家企業上市,其中祁連國際在NASDAQ上市企業,兆科眼科、騰盛博藥2家在港交所上市,德源藥業、森萱醫藥成為首批北交所上市企業;另外在上交所上市6家,深交所上市5家,新三板上市1家。
2.融資分析
2021年,國內化學藥領域共發生融資金額1億元以上的融資事件57件,融資總金額達172億元。其中,10億元及以上融資事件2件,為珍視明藥業16.8億元戰略融資和騰盛博藥10.11億元C輪融資;5億元以上5件,分別為蘇州圣諾7.41億元E輪融資、福瑞達生物7.38億元戰略融資、極目生物6.96億元B輪融資、真實生物6.89億元B輪融資、銳格醫藥5.82億元B輪融資。從區域來看,上海(18)、江蘇(12)、浙江(9)、廣東(9)是融資數量最多的四個省市,也是融資總金額最高的四個省市。此外,江西省僅有1起融資事件,但單筆金額最高。
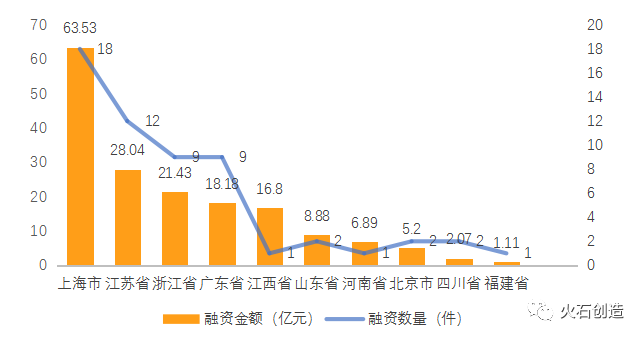
圖7:2021年各省市已披露金額超億元的化學藥領域融資情況
1.原料藥行業環保政策收緊,產業升級轉型迫在眉睫
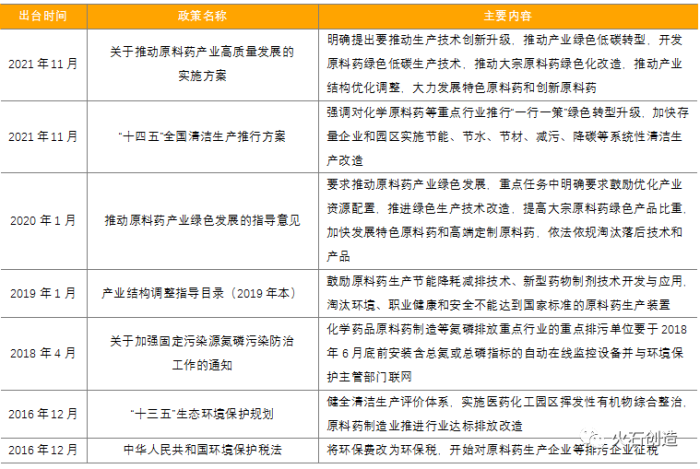
2021年國家對于原料藥行業的環保政策持續加碼,11月9日國家發展改革委、工業和信息化部聯合印發《關于推動原料藥產業高質量發展的實施方案》,明確提出要推動生產技術創新升級、推動產業綠色低碳轉型、推動產業結構優化調整等主要任務,對原料藥產業轉型升級和可持續發展具有重大意義,將進一步加快新形勢下原料藥產業高質量發展步伐,提升產業核心競爭力。
2.專利鏈接制度正式落地,推動藥品專利體系建設
2021年7月,國家藥品監督管理局和國家知識產權局聯合發布《藥品專利糾紛早期解決機制實施辦法(試行)》,標志著中國藥品專利鏈接時代的到來。為推動藥品專利鏈接制度落地,2021年7月5日,最高法和國家知識產權局分別發布了《關于審理申請注冊的藥品相關的專利權糾紛民事案件適用法律若干問題的規定》和《藥品專利糾紛早期解決機制行政裁決辦法》,以完善司法銜接。藥品專利鏈接制度落地對提升我國藥品研發創新能力,促進仿制藥高質量發展和推動醫藥領域的進步將起到重大作用,也進一步加快了中國版藥品專利體系的建設步伐。
3.從跟隨創新到源頭創新,創新藥為王時代開啟
11月19日,國家藥監局藥審中心(CDE)正式發布《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》,提出新藥在療效方面必須超過已經上市的藥物才能上市,關注真正具有臨床價值和壁壘的創新。從長遠來看,由Me-too/Me-better向BIC過渡,最終開發FIC,是我國從醫藥大國轉變為醫藥強國的重要途徑,指導原則的發布意味著我們是時候從跟隨創新轉向源頭創新,開啟創新藥為王的新時代。















